После первой успешной трансплантации легких 30 лет назад операция быстро стала стандартным методом лечения легочных заболеваний у отдельных пациентов. Достижения в области сохранения легких, хирургической техники и режима иммуносупрессии привели к рутинному выполнению трансплантации легких по всему миру для все большего числа пациентов с более широкими показаниями. Несмотря на это, нехватка доноров и хроническая дисфункция аллотрансплантата легких продолжают препятствовать достижению полного потенциала трансплантации легких.
Содержание
История
Попытки трансплантации легких произошли еще в 1946 году, когда советский ученый Владимир Демихов предпринял попытку трансплантации легкого у собаки – это была первая пересадка легкого в России и во всем мире. Эта трансплантация, в конечном счете, не удалась из-за бронхиального анастомоза, и трудности с этим анастомозом будут чумой клинической трансплантации легких в течение следующих 40 лет.
11 июня 1963 доктор Харди сообщил о первой трансплантации легких у человека; однако, пациент умер от почечной недостаточности после 18 дней. Первым реальным выжившим в эту раннюю эру трансплантации легких был пациент Фрица Дерома в Бельгии в 1971 году. Однако этот пациент прожил всего 10 месяцев. Неудачу этого раннего опыта в клинической трансплантации легких можно суммировать недостаточной иммуносупрессией и трудностями с бронхиальным анастомозом.
Появление циклоспорина в 1978 году привело к значительному улучшению выживаемости пациентов после трансплантации печени и почек. Это привело к возрождению интереса к трансплантации сердца / легких в Стэнфорде и пересадке легких в Торонто в 1981 году.
Первая успешная ортотопическая трансплантация сердца и легкого была завершена Рейцем и его коллегами в 1981 году и показала, что привитое легкое может выживать и функционировать у реципиента (женщина с идиопатической легочной гипертензией). Исследования, проведенные группой Купера в Торонто, показали, что использование кортикостероидов оказалось значительным фактором слабости бронхиального анастомоза. При использовании циклоспорина применение кортикостероидов может быть уменьшено, что приведет к улучшению заживления бронхов. В 1986 году программа трансплантации легких в Торонто сообщила о первых успешных одномоментных трансплантациях для двух пациентов с легочным фиброзом.
Эта команда продолжила первую успешную двойную трансплантацию легких, сначала с помощью технологии en bloc , которая использовала трахеальный анастомоз, а затем превратилась в двусторонний метод последовательной трансплантации, который не только улучшил исцеление дыхательных путей, но также имел дополнительное преимущество, избегая искусственного кровообращения, если это необходимо. Этот метод остается стандартной методикой, используемой по сей день.
Показания и противопоказания к трансплантации легких
Показания к трансплантации легких можно разделить на следующие основные категории заболеваний легких на конечной стадии:
- обструктивная болезнь легких;
- септическая болезнь легких;
- фиброзная болезнь легких;
- сосудистая болезнь легких.
Из этих категорий наиболее часто встречаются хронические обструктивные заболевания легких (ХОБЛ), кистозный фиброз (КФ), интерстициальный легочный фиброз и первичная легочная артериальная гипертензия. Было также показано, что пересадка легких при злокачественной опухоли эффективна лишь у некоторых пациентов.
Нынешнее международное общество по трансплантации сердца и легких (ISHLT), а также критерии отбора Американского торакального общества (ATS) включают соответствующий возраст, клиническую и физиологическую тяжесть заболевания, неэффективную или недоступную медицинскую терапию, существенные ограничения в повседневной жизни, ограниченную продолжительность жизни, адекватную сердечную функцию без значимой ишемической болезни, приемлемый статус питания, удовлетворительный психосоциальный профиль и систему эмоциональной поддержки.
Пациенты, которые проходят трансплантацию легких, подвергаются пожизненной иммуносупрессии и эпиднадзору. Таким образом, кандидаты на операцию по замене легких, которые есть курят или имеют наркотическую зависимости, психиатрические проблемы, влияющие на соблюдение послеоперационной помощи или отсутствие надежной сети социальной поддержки, не будут допущены к трансплантации.
Предыдущее злокачественное новообразование, особенно в течение 2 лет, ведущее к потенциальной трансплантации, также является противопоказанием из-за необходимости пожизненной иммуносупрессии. Действительно, хотя иммуносупрессия будет потенцировать инфекцию, хроническая инфекция является неотъемлемой частью септических заболеваний легких и создает проблему у этих пациентов. У пациентов с кистозным фиброзом обычно выделяются микобактериальные, мультирезистентные бактерии и Aspergillus. Предпринимаются усилия по искоренению или, по крайней мере, минимизации этих организмов до и после трансплантации. Более того, при наличии септического заболевания легких двусторонняя трансплантация легкого является единственной операцией, которая может быть выполнена, потому что оставлять септическое легкое у пациента, которое должно быть иммуноподавленным, нецелесообразно. Замена обоих органов снимает бремя инфекционных организмов и позволяет успешно провести трансплантацию при наличии большинства септических состояний легких.
Одним из примечательных исключений является комплекс Burkholderia cepacia, организм, оказывающий значительное негативное влияние на выживаемость после трансплантации. В нескольких докладах пациенты, инфицированные данным комплексом, особенно подвидом Burkholderia cenocepacia, имеют явно худшие показатели выживаемости, чем те, у кого их нет. Следовательно, некоторые центры трансплантации считают данную инфекцию абсолютным противопоказанием к трансплантации, но это остается спорным.
Пациенты со значительной дисфункцией других жизненно важных органов также представляют собой потенциальные противопоказания к трансплантации легких. Из-за возраста, курения, сердечная дисфункция является наиболее распространенной сопутствующей дисфункцией органа в популяции трансплантата легкого. Неинвазивное и инвазивное сердечное тестирование проводится во время тренировки для обеспечения адекватной сердечной функции, а одновременная трансплантация коронарного артериального шунтирования может быть выполнена во время трансплантации легкого, если функция левого желудочка сохраняется. Пересадка легких при туберкулезе невозможна!
Исторически возраст > 65 лет считался относительным противопоказанием к трансплантации легких, учитывая склонность к худшим исходам в этой группе. Однако 7,7% трансплантаций легких, проведенных в недавнюю эру (2004-2011), были у пациентов > 65 лет. Еще 21,6% были выполнены у пациентов в возрасте от 60 до 65 лет. Тщательная оценка сопутствующих заболеваний, а не только по возрасту, определяет кандидатуру на трансплантацию.
Пересадка легких при муковисцидозе
Трансплантация легких представляет собой сложную, с высоким риском, потенциально спасающая жизнь терапия терминальной стадии муковисцидоза (кистозный фиброз). Решение о проведении трансплантации предполагает сравнение вероятности выживания с трансплантацией и без нее, а также оценку влияния ожидания и пересадки на качество жизни пациента. Несмотря на то, что недавние демографические анализы системы распределения легких в США для населения с муковисцидозом вызвали споры о преимуществах трансплантации, исследования, проведенные в Соединенном Королевстве и Канаде, показали определенное преимущество для тех, кто получает трансплантацию.
Пересадка легкого – это комплексная спасательная терапия, используемая как у взрослых, так и у педиатрических пациентов с терминальной болезнью легких с часто драматическими результатами. Наличие реестра пациентов с кистозным фиброзом, организованного Фондом Муковисцидоза в Соединенных Штатах, облегчило изучение пациентов всех возрастов с КФ, которые получили трансплантацию легкого или сердца и легких. Тем не менее, даже для кистозного фиброза, гетерогенность кандидатов, сложность процедуры, изменчивость до и после трансплантации, низкий размер выборки в некоторых отдельных центрах и значительный спрос на терапию среди пациентов и семей ограничили формальную оценку эффективности.
Одно исследование эффективности пересадки легких, сосредоточенное на педиатрических пациентах с муковисцидозом, «Трансплантация легких и выживание у детей с кистозным фиброзом» Лиу и его коллегами в ноябре 2007 года, привело к значительным спорам после публикации. Основываясь на ретроспективном анализе, авторы пришли к выводу, что мало кто из детей с кистозным фиброзом получал выгоду после пересадки легких. Используя сводные данные из объединенной сети по обмену органами и регистров Фонда КФ для создания многовариантной модели выживания, включающей трансплантацию, Лиу и его коллеги предсказали улучшение выживаемости только для 5 из 514 перечисленных и только для 1 из 248 трансплантированных детей с муковисцидозом в период с 1992 по 2002 год.
С учетом неопределенности и противоречий, вызванных первоначальным докладом Лиу, в июне 2008 года была созвана конференция под названием “Международная перспектива трансплантации легких: результаты для взрослых и детей”, в которой приняли участие различные члены педиатрического сообщества и сообщества по трансплантации легких для взрослых, эксперты в области биостатистики. Участники определили дополнительные области, имеющие важное значение: адекватность существующих методов измерения качества жизни, трудности, связанные с измерением приверженности пациентов, различия в отборе кандидатов для включения в список и распределения органов между Соединенными Штатами и Соединенным Королевством, а также значение вариабельности методов лечения до и после трансплантации между центрами.
Трансплантация легких при муковисцидозе была впервые выполнена с использованием комбинированной трансплантации сердца и легкого в 1983 году, причем первые двусторонние трансплантации легких были выполнены через несколько лет. Кратковременный успех операции по пересадке легких спровоцировал рост в использовании процедуры и вызвал надежду у детей и взрослых, чья болезнь легких прогрессировала до конечной стадии. Каждый год приблизительно 200 пациентов с кистозным фиброзом, включая приблизительно 25 детей, подвергаются трансплантации легкого в Соединенных Штатах.
Донорское распределение легких
В Соединенных Штатах распределение легких первоначально основывалось только на времени ожидания без учета тяжести заболевания или потенциальной выгоды. Многие реципиенты были помещены на раннем этапе в список ожидания, чтобы выиграть время, но когда легкое в конечном итоге было доступно, пациент, возможно, еще не ухудшился до точки, требующей трансплантации. С другой стороны, пациенты с более тяжелой потребностью в пересадке часто не доживали до получения трансплантата.
В 2005 году была введена новая стратегия распределения легких (Egan, 2006 ), известная как оценка распределения легких (LAS). Эта оценка концептуально основана на степени потребности в трансплантации и вероятности выживания после замены легких. Для этого с помощью статистических моделей, основанных на клинических и физиологических характеристиках пациента, рассчитываются показатель срочности (ожидаемое количество дней, прожитых без трансплантации в течение дополнительного года ожидания) и показатель выживаемости после трансплантации (ожидаемое количество дней, прожитых в первый год после трансплантации)
Мера срочности вычитается из меры пособия, а затем нормализуется для получения LAS. Пациенты, которые получали больше баллов по системе, быстрее получали новые легкие.
Пересадка легких детям
Трансплантация легких для детей также превратилась в приемлемую терапию. К примеру, в России, в настоящее время более 100 детей ожидают трансплантации легких. Показания к педиатрической трансплантации легких отличаются от показаний для взрослых и стратифицируют в зависимости от возраста.
Дети в возрасте менее 1 года страдают в основном от врожденных пороков, таких как врожденные пороки сердца, дисфункция сурфактантов и легочные сосудистые расстройства. Кистозный фиброз становится основным показателем через 1 год. Идентификация приемлемых кандидатов для педиатрической трансплантации легких затруднена, особенно в молодом возрасте. Мировой опыт у этой группы населения ограничен, и естественная история многих из этих врожденных заболеваний не всегда ясна. Кроме того, необходимо тщательно оценить готовность родителей приступить к требовательной предоперационной и послеоперационной помощи, необходимой для педиатрической трансплантации легких.
Выбор донора легких
После того, как донор идентифицирован и выделен потенциальному реципиенту, органы-доноры должны быть проверены на качество и изъяты у донора. Как и вся трансплантация твердых органов, трансплантация легких еще более ограничена количеством доступных донорских органов. Однако нехватка при трансплантации легких усугубляется низким коэффициентом использования предлагаемых донорских органов.
Согласно данным United Network for Organ Sharing, во всем мире в 2012 году из 8143 умерших доноров, использовалось только 1708 донорских легких – 21%. В качестве сравнения, из тех же доноров было извлечено 7419 почек. Международное общество по трансплантации сердца и легких (ISHLT), которое определяет идеальных доноров, имеет строгие критерии по отбору органов. Хотя это помогает провести безопасную клиническую трансплантацию легких, комбинация строгих критериев в сочетании с повышенной восприимчивостью легких приводит к низкому коэффициенту использования.
Критерии ISHLT для принятия легкого:
- Возраст < 55 лет
- Совместимость ABO
- Рентгенограмма без патологий
- PaO2 >300 on FiO2 = 1.0, PEEP 5 cm H2O
- История курения < 20 упаковок в год
- Отсутствие травмы грудной клетки
- Нет доказательств аспирации / сепсиса
- Нет предварительной сердечно-легочной хирургии
- Мокроты – отсутствие организмов
- Отсутствие гнойных выделений при бронхоскопии
Без соблюдения всех этих критерий невозможно стать донором легких!
Оценка донорских легких в значительной степени является клиническим процессом. Помимо сопоставления группы крови и размеров органа, большая часть оценки является относительно субъективной и происходит во время извлечения. Перед вскрытием грудной клетки проводится рентгенография грудной клетки и бронхоскопия для исключения инфекции или анатомических аномалий.
Газообменная емкость донорских легких оценивается с помощью кислородного теста. После того, как грудная клетка открыта, хирург выполняет окончательную физическую оценку с помощью макроскопического наблюдения и пальпации, чтобы оценить соответствие легких и исключить внутреннее заболевание легких, области контузии, инфильтраты или узелки. Наблюдение за вентилируемыми легкими во время дефляции используется для дальнейшей оценки легочного соответствия. Если легкие считаются пригодными для использования, их извлекают и отправляют в центр трансплантации для будущей имплантации.
Сохранение легких
При первоначальном раннем опыте трансплантации, доноров привозили в соседнюю операционную комнату, извлекали легкие, дефлировали и местно охлаждали in situ для сохранения. Легкие после этого хранили выкачанным и погруженным в воду в гипотермическом физиологическом растворе и помещенным на лед для гипотермической консервации. Несмотря на короткий период ишемии, немедленное послеоперационное лечение чревато значительной послеоперационной дисфункцией первичного трансплантата и плохой сохранностью микроциркуляции легких и бронхов.
Современная консервация легких – это континуум, который начинается в момент объявления смерти и заканчивается после реперфузии у реципиента. На предшествующем этапе заботятся о сохранении эуволемии и избегании баротравмы. 1 г метилпреднизолона дается донору в качестве противовоспалительного средства для уменьшения воспаления, вызванного смертельным исходом, а также частично для замены любых стероидных дефицитов.
Во время извлечения легкие готовятся к транспортировке, промываются консервирующим раствором и накачиваются кислородом. Было обнаружено, что использование защитного раствора для промывки внеклеточного типа с низким содержанием калия, в сочетании с глюкозой и декстраном, является лучшим для длительного хранения холода. Это стало стандартом сохранения легких в большинстве программ трансплантации легких.
Для поддержания тонкой альвеолярной структуры и обеспечения кислородом обмена веществ легкие накачиваются 50% кислородом до их удаления из организма. Это важное отличие сохранения легких по сравнению с другим сохранением органов в том, что легкое хранится в аэробном гипотермическом ишемическом состоянии, так что аэробный метаболизм может продолжаться на фазе хранения, хотя и с уменьшенной скоростью.
Донорские легкие после смерти мозга
В настоящее время самым большим пулом донорских органов являются органы, полученные от доноров после смерти мозга. Прекращение неврологической функции у этих людей приводит к юридическому определению смерти, но органы остаются жизнеспособными в течение определенного периода времени из-за сохранности сердечной функции.
Хотя эта ситуация, по-видимому, идеальна для трансплантации органов, многие факторы могут способствовать повреждению легких у донора в процессе смерти и последующего донорского обслуживания в отделении интенсивной терапии. Прямые травмы, аспирация, пневмония, и осложнения интенсивной терапии, такие как искусственная вентиляция легких травмы, ателектаз, токсичность кислорода и объем перегрузки – это все общие причины травмы.
Что еще более важно, хорошо известно, что сам процесс смерти мозга может нанести ущерб потенциальным донорским органам. После смерти мозга происходит системный воспалительный ответ, известный как «цитокиновая буря». Повышенные противовоспалительных цитокинов было обнаружено в органах после смерти головного мозга на моделях грызунов (Takada, 1998 год) и в мозге умерших пациентов (Lopau, 2000 год).
Второй “шторм”, который происходит после смерти мозга, – это шторм катехоламина. В попытке защитить церебральную перфузию во время смерти мозга, тело выпускает большое количество катехоламинов. Этот всплеск катехоламинов вызывает значительную системную гипертензию, что приводит к повышенному левостороннему давлению сердца и последующему интерстициальному отеку, а иногда даже альвеолярному кровоизлиянию в легкое, что приводит к состоянию, известному как нейрогенный легочный отек. Это, как правило, исключает использование легких для трансплантации из-за плохой оксигенации. Однако, неврогенный легочный отек – это протекающий капиллярный синдром, который полностью излечим.
Операция по пересадке легких
Для удовлетворения определенных ситуаций были разработаны различные процедуры трансплантации легких. Наиболее известными являются: трансплантация одного легкого, где левое или правое легкое пересаживается в реципиента, а контралатеральное родное легкое остается на месте; и двусторонняя трансплантация легкого, где пересаживаются оба легких. Решение о пересадке одного или двух легких зависит от показаний к факторам трансплантации и реципиента, а также доступности доноров.
Новые данные свидетельствуют о том, что двусторонняя трансплантация легких приводит к длительной выживаемости, поскольку она обеспечивает более функциональную легочную ткань как буфер против дисфункции легких. По той же причине маргинальные донорские органы с большей вероятностью будут использоваться при имплантировании в качестве двусторонней трансплантации легких. Специфические показания также требуют трансплантации двойного легкого. Хотя это и не является абсолютным показанием, двусторонняя трансплантация при сосудистых заболеваниях легких с повышенным давлением в артериях является лучшим решением, поскольку она позволяет избежать осложнений с гемодинамической нестабильностью и тяжелой первичной дисфункцией трансплантата после операции.
Хотя вышеупомянутые процедуры трансплантации легких на сегодняшний день являются наиболее распространенными, были разработаны альтернативные процедуры, которые могут использоваться в уникальных ситуациях. Донорское легкое может быть неанатомически уменьшено по объему, чтобы вписаться в меньшего получателя. Комбинированная трансплантация сердца / легких зарезервирована для случаев, когда необратимая болезнь сердца возникает в сочетании с необратимой болезнью легких.
Хирургический метод
В целом, большинство центров трансплантации легких избегают повседневного использования искусственного кровообращения при трансплантации легких. Для трансплантации одного легкого больное легкое иссекается, а новое легкое имплантируется, пока пациент поддерживается на контралатеральном родном легком. Если пациента нельзя поддерживать таким образом из-за значительной гипоксии, гиперкарбии или гемодинамической нестабильности, тогда используется сердечно-легочное шунтирование (СЛШ).
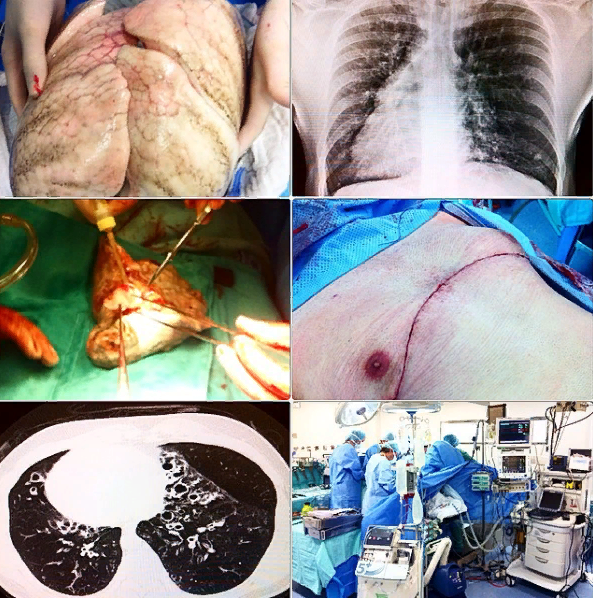
Исходная методика венозного анастомоза для трансплантации легких состоит в анастомозировании атриума от донора к реципиенту с помощью перевязочного шовного материала. Предсердный анастомоз, описанный первоначально в 1950 году, дает преимущества перед прямыми анастомозами легочной вены, поскольку он позволяет накладывать большую поверхность более жесткой ткани и ограничивает количество анастомозов до одного. Натяжной шов давно используется экспериментально для венозного анастомоза у крупных животных, чтобы снизить риск тромбоза. Кроме того, в клинической практике также сообщалось о анастомозе двух легочных вен отдельно во время единственной трансплантации легкого.
Двусторонние трансплантации легких выполняются в виде последовательных трансплантаций одного легкого с помощью разреза расщепления или двусторонних антеролатеральных торакотомий, если они предпочтительны и технически осуществимы.
Стратегия последовательной трансплантации не только позволяет избегать сердечно-легочного шунтирования в большинстве случаев (60% -75%), но также позволяет избежать трахеального анастомоза, который использовался в первоначальной операции трансплантации 2 легких единым блоком. Трахеальный анастомоз был чреват анастомозными осложнениями, связанными с нестабильным кровоснабжением трансплантатной дыхательной системы на этом уровне.
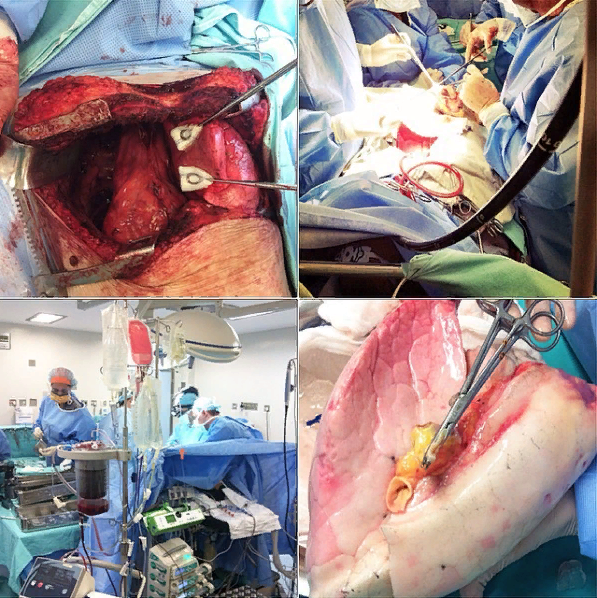
После вскрытия грудной клетки проводится мобилизация каждого из нативных легких. В первую очередь удаляют легкое с беднейшей функцией, и начинается имплантация первого трансплантата. После проводится перфузия и вентиляция легкого. В дальнейшем получатель зависит от функции этого легкого, поскольку контралатеральная сторона удаляется, а второе легкое имплантируется. Гемодинамическая нестабильность, повышенное артериальное давление в легочной артерии или гипоксемия обусловливают необходимость использования сердечно-легочного шунтирования. В конечном счете, только у ~ 25% реципиентов, не страдающих легочным сосудистым заболеванием, требуется проведение СЛШ.
Послеоперационный уход
Уход за реципиентом в ближайшем послеоперационном периоде фокусируется на вентиляторной и гемодинамической поддержке. В неосложненных случаях отлучение от вентилятора может начаться быстро в течение первых 6-12 часов. Из-за повышенной сосудистой проницаемости и расколотых лимфатических узлов пересаженного легкого развитие отека не является чем-то необычным. Таким образом, предпринимаются попытки минимизировать центральное венозное давление. Часто используются вазопрессоры и инотропы, а не вливание объема.
Основным страхом после операции является отказ пересаженного легкого функционировать. Такой сценарий может быть имитирован объемной перегрузкой, сердечной дисфункцией, пневмонией, аспирированием, опосредованным антителом отторжением, легочной тромбоэмболией или техническими осложнениями, такими как окклюзия венозного оттока. ри отсутствии этих состояний первичная дисфункция трансплантата (ПДТ) становится диагнозом исключения. ПДТ является основной причиной заболеваемости и смертности в первые 72 ч после трансплантации.
ISHLT опубликовал систему оценки для PGD, аналогичную той, которая применяется для ARDS. Пациентов оценивают по этой системе классификации в момент сразу после трансплантации, а затем через 24, 48 и 72 ч после трансплантации. Те, у кого PGD 3, сохраняющиеся до 72-часовой точки, имеют худшие краткосрочные и долгосрочные результаты.
Послеоперационная иммуносупрессия
Иммуносупрессия обычно состоит из схемы с тремя лекарственными препаратами: ингибитор кальциневрина (циклоспорин или такролимус), нуклеотидный блокирующий агент (азатиоприн или ММФ) и кортикостероиды. Индукционная терапия, использование мощного иммуносупрессивного агента для истощения Т-клеток, таких как антитела против IL2R, антитела против CD52 или антитимоцитарный глобулин, вызывает споры при трансплантации легких. Считается, что использование индукционной терапии способствует сильной ранней иммуносупрессии во время отторжения трансплантата, которое, скорее всего, произойдет, и может привести к более менее токсическому режиму поддерживания в будущем. Хотя проспективные рандомизированные плацебо-контролируемые исследования не показали существенной пользы, данные реестра показывают, что ~ 50% программ трансплантации легких используют индукционную терапию основываясь на логической экстраполяции из продемонстрированных результатов использования индукционной терапии в других видах трансплантации.
Осложнения
Глобальное бремя болезней легких продолжает увеличиваться и теперь занимает прочное место среди ведущих причин смерти. Трансплантация легких является широко распространенной терапией для легочных заболеваний на конечной стадии. Частота тяжелых осложнений в раннем послеоперационном периоде колеблется от 15% до 30%. Сообщалось, что тяжелые осложнения, связанные с венозным анастомозом, встречаются в 1-2% случаев и приводят к венозному застою или цереброваскулярной эмболии. Однако недавние данные свидетельствуют о том, что частота осложнений, возможно, была ранее недооценена. Действительно, аномалии в окрестности легочного венозного анастомоза наблюдались у 23-29% пациентов, перенесших трансплантацию легких в некоторых центрах, где легочные венозные анастомозы систематически подвергались скринингу с помощью трансэзофагеальной (чреспищеводной ) эхокардиографии.
Сколько живут после пересадки легких
Трансплантация легких не является лекарством от болезни легких; медианная выживаемость для взрослых после замены легких составляет всего 6,4 года.
Несмотря на то, что было показано, что трансплантация легкого дает повышенную выживаемость пациентам с легочной болезнью конечной стадии, выживаемость после трансплантации легких по-прежнему составляет лишь ~ 50% в течение 5 лет. Основные причины смерти после трансплантации легких зависят от времени после трансплантации. Тридцатидневная смертность обычно связана прежде всего с хирургическими проблемами, сохранением донорского легкого и первичной дисфункцией трансплантата. Инфекционные причины, злокачественность и хроническая дисфункция аллотрансплантата легких (CLAD) преобладают в последующем посттрансплантационном периоде. Несмотря на значительное улучшение краткосрочных результатов из-за улучшения консервации и хирургической техники, долгосрочная выживаемость после трансплантации легких остается на уровне 50% 5-летней выживаемости. Помимо нехватки поставок донорского органа, хроническая дисфункция аллотрансплантата легких остается самой серьезной проблемой для долгосрочного успеха трансплантации и эта проблема сейчас в центре исследований.
Сколько стоит пересадка легких
Стоимость трансплантации включает в себя предварительное тестирование, саму операцию, послеоперационные затраты на восстановление и цена может варьироваться в зависимости от региона и больницы.
Типичная стоимость трансплантации составляет 500 000 – 800 000 долларов США, в зависимости от того, включает ли процедура одно или оба легких. В отчете о стоимости трансплантации органов и тканей в Соединенных Штатах консалтинговой фирмой Milliman было установлено, что общая стоимость одного трансплантата легкого составляет 561 200 долларов США. Эта стоимость включает в себя:
- 10 300 долларов США за месяц ухода
- 73 100 долларов США на закупку органа
- 302 900 долларов США на проведение трансплантации в больнице
- оплата работы хирурга составляет 33 500 долларов США
- 23 700$ на иммуносупрессанты и другие отпускаемые по рецепту лекарства
В докладе оценивается общая стоимость двойной трансплантации в размере 797 300 $
Исследуя информацию в сети можно установить, что стоимость пересадки легких сильно зависит от страны и центра трансплантации:
- Израиль – 120-300 тыс. долларов США
- Европейский союз – от 70 000 до 100 000 евро
- Индия – от 50 000 $
Пересадка легких в России
На данный момент трансплантация легкого в России не имеет широкого резонанса. Граждане страны предпочитают посещать клиники других государств для проведения операций такого уровня. Проведение трансплантации легких позволит снизить уровень смертности в стране.
- Цена трансплантации легких в России – от 150 000 долларов
Делают ли пересадку легких в Москве? Да! Ниже мы укажем список медицинских центров, которые смогут помочь в данном вопросе.
- Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского Департамента здравоохранения города Москвы
- Научно-исследовательский институт пульмонологии ФМБА России
Пересадка легких прочно утвердилась как лечение болезни легких на конечной стадии. В настоящее время более широкое применение трансплантации легких ограничено наличием и пригодностью донорских органов. Трансплантация легких стала приемлемым вариантом лечения пациентов с терминальной стадией заболевания легких. Отбор доноров и распределение органов должны осуществляться в соответствии с конкретными руководящими принципами. Статистика выживания остается обнадеживающей и продолжает совершенствоваться с учетом накопленного опыта. Улучшение толерантности к физической нагрузке и качество жизни были продемонстрированы в годы после трансплантации. Остальные препятствия включают ограниченную доступность донорских органов, долгосрочную функцию трансплантата и выживаемость пациентов.
Нет одного легкого